La Food and Drug Administration (FDA) a donné son feu vert à la commercialisation du Yuvezzi (Tenpoint Therapeutics).
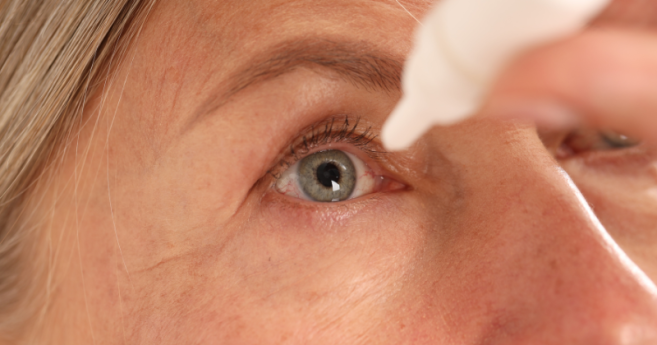
Initialement connu sous le nom de Brimochol PF, le Yuvezzi (dosé à 2,75 % de carbachol et 0,1 % de tartrate de brimonidine) devient ainsi le premier collyre bi-composé approuvé pour la prise en charge de la presbytie chez l'adulte aux États-Unis.
Contrairement aux solutions de première génération reposant sur un agent unique, le Yuvezzi mise sur la complémentarité de deux molécules pour agir sur le contrôle pupillaire. Cette double action augmente la profondeur de champ et améliore l'acuité visuelle de près sans compromettre la vision de loin.
Sa mise sur le marché américain est prévue pour le deuxième trimestre 2026.
Des résultats cliniques probants sur le long terme
L'approbation s'appuie sur les données de deux études de phase 3, BRIO-I et BRIO-II.
Dans l'étude BRIO-II, le collyre a atteint tous ses critères d'évaluation primaires. Les patients ont montré une amélioration statistiquement significative de l'acuité visuelle de près binoculaire non corrigée (gain de 3 lignes ou plus) sur une durée de 8 heures, le tout sans perte de ligne en vision de loin.
L'étude BRIO-II constitue à ce jour la plus longue étude de sécurité menée sur la presbytie (12 mois). Aucun événement indésirable grave lié au traitement n'a été observé.
Tolérance et confort
L'un des points de différenciation mis en avant par Tenpoint Therapeutics concerne la tolérance oculaire. Les effets secondaires les plus fréquents restent classiques pour cette classe de produits (maux de tête, vision trouble temporaire, légère douleur oculaire).
Toutefois, les rapports d'hyperémie oculaire (œil rouge) sont restés faibles. Dans l'étude BRIO-II, le taux d'hyperémie était de seulement 2,8 % pour les sujets sous Yuvezzi, contre 10,7 % pour ceux recevant du carbachol seul.
Si l'homologation américaine du Yuvezzi est désormais actée outre-Atlantique, aucune information n'a encore été communiquée quant à une éventuelle procédure d'enregistrement auprès de l'Agence européenne des médicaments (EMA).

![[Vidéo] Reportage sur les opticiens en Ehpad : une expérimentation prometteuse face au vieillissement de la population](https://www.acuite.fr/sites/acuite.fr/files/styles/home_slider_video/public/articles/reportage_refraction_ehpad_opticien_lunettes_senior.png?itok=885hmxLm)
![[Vidéo] Les Ray-Ban Meta, une solution pour les déficients visuels ? Nous avons testé](https://www.acuite.fr/sites/acuite.fr/files/styles/home_slider_video/public/articles/test_rb_meta_mavoyant.png?itok=PQG6A-HL)